免疫疗法正迅速发展成为肿瘤治疗的重要手段之一,越来越多地与已经成熟的肿瘤治疗手段(如手术、化疗、放疗和靶向治疗)联合应用于临床。自然杀伤(NK)细胞治疗已被证明可安全有效的用于多种肿瘤的治疗。目前,多数临床试验使用来自外周血或脐带血或NK-92细胞的原代NK细胞。然而,原代NK细胞来源受到一定的限制,例如供体依赖性,体内低持久性和遗传修饰困难。干细胞来源的NK细胞是同质的,易于在克隆水平上进行基因修饰,并可以扩大到临床规模,是目前最有发展前景的过继免疫治疗肿瘤的潜在细胞群。2019年《Expert Opin Biol Ther》杂志上发表了题为《The rise of human stem cell-derived natural killer cells for cancer immunotherapy》的综述,重点介绍了利用干细胞源性NK细胞进行肿瘤免疫治疗的最新进展和提高其抗肿瘤活性的策略,现介绍如下。

1.NK细胞生物学特性及其在细胞治疗中的作用
NK细胞是先天免疫系统的淋巴细胞,具有杀死受感染和转化细胞的内在能力,且无需预先抗原致敏。NK细胞通过整合激活和抑制受体的信号,可以将健康细胞与感染或肿瘤靶点区分开。杀伤性免疫球蛋白样受体(KIRS)和CD94-NKG2A是两种主要的抑制性受体,它们通过识别正常存在于健康细胞上的I类主要组织相容性复合体(MHC)分子,防止NK细胞杀死自卫细胞。感染或肿瘤细胞常常下调或丢失MHC I类分子以逃避T细胞介导的免疫监视,而被NK细胞识别和杀死。此外,NK细胞可以通过激活受体来激活,包括NKG2D、KIR(激活形式)、自然细胞毒性受体和CD16。感染细胞或肿瘤细胞通常会增加这些激活受体的配体表达。
NK细胞可以通过以下几种不同的机制杀死靶细胞。首先,它们可以通过释放含有颗粒酶和穿孔素的细胞溶解颗粒来溶解肿瘤细胞。其次,NK细胞可以通过死亡受体途径诱导其表面的死亡配体,如第一凋亡信号配体(FASL或CD95L)和肿瘤坏死因子(TNF)相关的凋亡诱导配体来触发肿瘤细胞凋亡。此外,NK细胞还通过抗体依赖性细胞毒性(ADCC)途径杀死目标,ADCC是CD16介导的关键效应器,使治疗性单克隆抗体(mAbs)的部分抗肿瘤作用得以实现。
近年来,过继细胞疗法已成为治疗复发和难治性恶性肿瘤的一种新的、有希望的治疗方法。嵌合抗原受体(CAR-T)疗法在2017年获得FDA批准的两种治疗白血病的产品中引起了广泛关注。由于CAR-T疗法需要多个高度专业化的步骤,这些步骤耗时且非常昂贵。此外, CAR-T疗法(如细胞因子释放综合征(CRS)、神经毒性和肿瘤溶解综合征)的毒性是限制这种刺激疗法广泛应用的另一个障碍。目前,大多数临床试验都使用了来自外周血(PB-NK)的NK细胞或来自脐带血(UCB-NK)的NK细胞,这些细胞来源依赖于供体,而不是来自单一可再生来源,从而限制了开发标准化的“现成”细胞的潜力。人类胚胎干细胞(hESC-NK)和人诱导多能干细胞(hiPSC-NK)的NK细胞已被证明具有与原代细胞相似的表型和功能,更为同质,可以在克隆水平上进行基因修饰,并且易于扩展到临床规模,是目前最有前景的发展成标准化过继性NK细胞的理想细胞来源。
2.NK细胞过继治疗的概述
迄今为止的临床试验表明,NK细胞具有有效的抗急性髓系白血病(AML)作用,且不引起严重的不良反应。在早期临床试验中,细胞因子(通常为IL-2或IL-15)刺激后的自体NK细胞被用于肿瘤治疗。由于NK细胞的抗肿瘤活性通常被自身人类白细胞抗原(HLA)分子所抑制,因此使用自体NK细胞的临床疗效有限。随后,利用HLA单倍体供体的同种异体NK细胞来阻止NK细胞活性的自我抑制。一项使用同种异体PB-NK的试点试验表明,约30%的难治性或复发性AML患者可以完全缓解。除AML外,异基因NK细胞疗法还被用于治疗各种实体瘤,如肝细胞癌、肺癌、卵巢癌、乳腺癌、肾细胞癌和大肠癌。
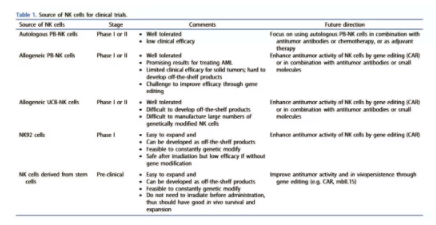
3.使用NK细胞治疗的临床试验
来自不同来源的NK细胞已用于过继性NK细胞临床试验(表 1),包括PB-NK细胞(自体和同种异体细胞)、脐带血分离的NK细胞(UCB-NK)和NK细胞系NK-92。使用PB-NK和UCB-NK的主要局限性在于,它们非常依赖于供体,而不是来自单一的可再生来源,因此很难生成标准化的“现成”细胞免疫治疗产品,并且难以开发多剂量治疗。同种异体NK细胞在过继转移环境中通常只存活数周,需要多剂量。此外,原代NK细胞一般很难进行基因修饰。NK-92是来源于NHL患者的人NK细胞系。它们具有良好的特征、同质性、易于基因修饰、无限制的NK细胞来源,这些都是现成的NK细胞治疗产品的诱人特性。一些研究用不同的CARS或CD16设计了NK-92细胞,以增加血液学和实体恶性肿瘤的细胞毒性。然而,由于担心致瘤性,在给药前需要对NK-92细胞进行照射,从而限制了这些细胞的抗肿瘤活性。
4.从干细胞中产生人NK细胞
与原代NK细胞和NK细胞系相比,使用hESCs(hESC-NK)或hiPSCs(hiPSC-NK)衍生的NK细胞有几大优点。首先,hESC-NK / hiPSC-NK细胞是同质的、可重复的,具有无限的NK细胞来源,可以开发多剂量治疗方案,消除了供体与供体之间的变异性,以及使用PB-NK或UCB-NK细胞时限制细胞数的问题。其次,利用慢病毒、转座子或CRISPR-Cas9系统等多种基因修饰技术对干细胞进行修饰,然后将NK细胞与基因修饰的干细胞进行区分,从而提高抗肿瘤活性或体内持久性。使用hiPSC-NK细胞治疗肿瘤的临床试验正在研究性新药(IND)应用中。
5.NK细胞过继免疫治疗面临的挑战
尽管人们对使用过继性NK细胞疗法治疗肿瘤的兴趣越来越大,但在人类试验中的疗效有限,尤其是实体肿瘤。主要原因之一是过继转移的原代NK细胞或照射的NK-92细胞在体内的持久性较低,从而限制了其抗肿瘤功效。此外,肿瘤微环境可通过多种不同的机制导致NK细胞衰竭和功能障碍。例如,肿瘤细胞在肿瘤微环境中产生的许多免疫抑制性细胞因子和代谢产物(如TGF-β、前列腺素E2、吲哚胺2,3-二加氧酶和腺苷)可以抑制NK细胞的增殖和功能。此外,肿瘤微环境中含有丰富的其他宿主免疫细胞(如骨髓源性抑制细胞和调节性T细胞),这些细胞可被IL-2激活以抑制NK细胞功能并限制其抗肿瘤活性。最后,未经基因修饰的NK细胞对某些肿瘤靶点(如B细胞淋巴瘤和绒毛膜癌细胞)具有低或无细胞毒性,可能是由于缺乏NK细胞激活受体的配体和抑制配体的高表达。此外,在与肿瘤细胞相互作用后,激活受体(如NKG2D、NKp30、NKp46或DNAM-1)在NK细胞上表现为下调。因此,改善NK细胞的体内持久性,克服免疫抑制性肿瘤微环境,通过基因修饰增强抗肿瘤细胞毒性,对于提高NK细胞的抗肿瘤活性和开发下一代过继NK细胞治疗产品是非常可取的。然而,如前所述,目前临床试验中使用的NK细胞要么很难进行基因修饰(原代NK细胞),要么需在给患者注射前进行照射(NK-92细胞)。相比之下,hESC/iPSC-衍生的NK细胞由于其同质化和基因工程改善抗肿瘤功能的可行性,是开发标准化的“现成”免疫治疗产品的理想细胞群(图1)。
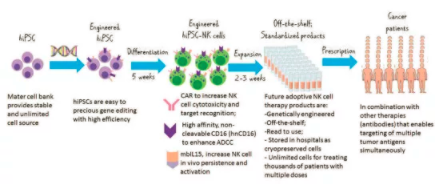
图 1. 下一代过继性NK细胞治疗产品的开发
来自健康捐赠者的体细胞的HIPSC作为主细胞库储存,以提供一致和无限的起始细胞群。hiPSC是在一个克隆水平上利用各种技术(如CRISPR)精确地进行基因工程,并进行分化,生产hiPSC-NK细胞需要大约5周的时间。目前正在探索的几种改善NK细胞抗肿瘤功能的策略,包括配备NK细胞CAR以增加细胞毒性和靶点识别,hNCD16以增强ADCC,以及MBIL15以增加体内持久性和活化。这些策略在临床前异种移植小鼠模型中显示了阳性结果,为临床试验提供了保证。在扩增2-3周后,即可获得现成的临床规模。细胞以冷冻保存的形式储存,可生成多剂量,用于治疗成千上万的患者。HiPSC-NK细胞可与其他疗法结合使用,尤其是现成的抗肿瘤抗体,使多个肿瘤抗原的靶向同时具有驱动机制,旨在最终治愈肿瘤。
6.提高hiPSC-NK细胞体内持久性的策略
细胞因子如IL-2和IL-15是参与NK细胞功能的关键分子,包括分化、增殖、活化和存活。IL-2已广泛应用于体外扩增NK细胞和延长患者注入的NK细胞存活率。然而,白细胞介素-2可在患者中引起严重的副作用(如毛细血管渗漏综合征)。IL-2还激活Treg细胞,从而抑制NK细胞功能,降低其抗肿瘤作用。与IL-2相似,IL-15已被证明可刺激NK细胞的增殖,IL-15水平与患者输注NK细胞的体内扩增相关。在非人类灵长类动物中,IL-15刺激了NK细胞的扩展,但不产生明显的毒性。据报道,IL-15在体外也能增加NK细胞的活化受体NKP30的表达,从而改善了NK细胞的细胞毒性。因此,IL-15与IL-2比较,临床上有许多IL-15产物的开发,包括IL-15超激动剂(ALT 803)。患者对ALT-803有良好的耐受性,能够在体内促进CD8+T和NK细胞的扩增,而不刺激Treg细胞。在生理条件下,血清中的IL-15与IL-15Rα结合形成天然复合物,其表达于二聚体IL-15β(CD122)/γC(CD132)受体(包括NK细胞)的细胞。在与IL-15β和γc亚单位结合后,IL-15激活了Janus激酶1和Janus激酶3,从而导致信号转导的磷酸化和激活以及转录3(STAT3)和STAT5的激活。
一组研究人员通过将人IL-15基因与编码的CD8α连接,并将其转化为PB-NK细胞,从而产生了膜结合的IL-15(mbIL15)。研究表明,在没有外源性细胞因子的情况下,表达mbIL15的人NK细胞在体外和体内的存活和扩增要优于未经修饰的NK细胞或表达非膜结合的IL-15的NK细胞。此外,mbIL15 NK细胞在体外对白血病、淋巴瘤和实体瘤细胞具有增强的细胞毒性,在异种移植模型中对白血病和肉瘤细胞具有增强的细胞毒性。最近,另一组通过将IL15和IL15Rα与Ser-Gly连接物融合,并使用“睡美人”转座系统在T细胞中与第二代CAR共表达,创造了不同的mbIL15。mbIL15-CAR T细胞在白血病异种移植模型中表现出改善的持久性和抗肿瘤作用。
另一种增强NK细胞中细胞因子信号的方法是调控细胞因子信号的负调节。 细胞因子信号转导(SOCS)蛋白(CIS;SOCS1-7)的抑制因子是细胞因子信号传导的重要负调节因子,CIS是NK细胞介导的肿瘤免疫中一个有效的抑制检查点,因为在小鼠NK细胞中,细胞因子诱导的含SH2蛋白(CISH)的缺失使其对IL-15,增强了对肿瘤的细胞毒性。hiPSC-NK细胞中CISH的缺失表明CIS可以调节人类NK细胞的抗肿瘤活性。CAR和IL-15信号的结合是一种提高NK细胞抗肿瘤功能的有效途径。
7.通过增强ADCC提高hiPSC-NK细胞抗肿瘤细胞毒性
ADCC是一种由NK细胞介导的关键效应器机制,能够发挥治疗性单克隆抗体的抗肿瘤作用。该过程由CD16a介导,CD16a结合单克隆抗体的Fc部分,并被金属蛋白酶ADAM 17切割。CD16a有两个单核苷酸多态性(SNP)变体,即高Fc亲和力的FcγRIIIA158V和低亲和力的FcγRIIIA158F。当用西妥昔单抗、曲妥珠单抗或利妥昔单抗治疗时,CD16a高亲和力的SNP患者比低亲和力的SNP患者有更高的客观反应性和无进展生存率。一项初步研究确定了CD16a的ADAM 17裂解位点,并通过突变该裂解位点,创造了一个高亲和力CD16a(hnCD16)的不可折叠版本。用hnCD16设计的hiPSC-NK细胞已显示出稳定的CD16a表达,并对刺激后的激活诱导脱落具有抵抗力,因此在体外和异种移植小鼠模型中对各种肿瘤靶点显示出增强的ADCC效应。hnCD16设计的hiPSC-NK细胞的好处在于,经修饰的NK细胞可以与任何可用的抗肿瘤抗体结合,并普遍针对不同的肿瘤,而无需使用针对每个肿瘤抗原的CARs对其进行修饰。
8.表达CAR的hiPSC-NK细胞
最近研究了不同来源的NK细胞(如Pb-NK、UCB-NK和NK92细胞)上的CARs,以指导抗肿瘤活性。针对一系列抗原(包括CD19、CD20、ErbB2(HER2)、CD38、EGFR、GD2等)的CAR工程NK-92细胞在临床前体内模型中显示出有希望的结果。此外,用CAR-CD19、IL-15和可诱导caspase-9(iC9)自杀基因设计的UCB-NK细胞在Raji淋巴瘤小鼠模型中显示出改善的持久性和抗肿瘤活性。
最近报道了用一种新的CAR(包含NKG2D的跨膜结构域、2B4共刺激结构域和介导强抗原特异性NK细胞信号的CD3ζ信号结构域)设计的hiPSC-NK细胞。这种CAR(称为NK-CAR)是专门为增强针对间皮素表达肿瘤的NK细胞活性而设计的。在卵巢癌异种移植模型中,与PB-NK细胞、未修饰的iPSC-NK细胞或表达T CAR的细胞iPSC-NK(CD28-41BBζ)相比,NK-CAR表达的iPSC -NK细胞显著抑制肿瘤生长并延长生存期。有趣的是,在同一个体内模型中,在腹腔注射10天后,表达NK-car的iPSC -NK细胞在循环、脾脏和腹膜液中的持久性高于PB-NK细胞和iPSC -NK细胞。此外,在卵巢癌异种移植模型中,第三代CAR-表达 T细胞与CAR-表达 NK细胞的比较表明,CAR-表达NK细胞比CAR-表达 T细胞更安全地发挥抗肿瘤作用。
“论肿道麻”点评
细胞过继免疫疗法的最新进展使肿瘤治疗发生了革命性的变化。为了提高NK细胞的抗肿瘤活性,目前的临床试验要么将NK细胞与抗体结合起来增强ADCC,要么使用基因修饰的NK细胞(如NK-CAR)(表1)。来源于人类干细胞源性的NK细胞为过继免疫治疗提供了一个平台,可以生产出统一的、一致的、现成的、临床规模的、具有改进活性的基因工程NK细胞。尽管有希望,但人类干细胞源性NK细胞的应用仍存在一些挑战。首先,与同种异体PB-NK或UCB-NK细胞一样,由于被受体的T细胞拒绝识别不匹配的MHC,来自HLA不匹配供体的未经修饰的iPSC- NK细胞在患者中的持久性较低。因此,多剂量和基因修饰以增加iPSC -NK细胞的持久性是非常需要的。其次,尽管迄今为止大多数临床试验表明,自体或同种异体NK细胞是安全的,但随着iPSC -NK细胞的生存率和抗肿瘤活性的提高,NK细胞治疗(如CRS)可能发生潜在细胞毒性,最终可能导致干细胞向NK细胞分化过程的基因不能在iPSC -NK细胞中被修饰。随着通过基因编辑提高NK细胞的抗肿瘤活性和体内持久性,并结合CAR-T细胞治疗的细胞毒性临床经验,NK细胞过继疗法将会逐渐成为肿瘤治疗的前沿之一。
(编译 董静;审校 缪长虹)
参考文献:
Wang K, Han Y, Cho WC, Zhu H. The rise of human stem cell-derived natural killer cells for cancer immunotherapy. Expert Opin Biol Ther. 2018 Dec 24:1-8. doi: 10.1080/14712598.2019.1559293.
版权声明
本公众号所有转载文章是出于传递信息,分享热点的目的,同时明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(marketing@Countstar.cn),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。


